Aussi bien dans le monde végétal que dans le règne animal, l’évolution a doté certaines espèces de mécanismes de défense redoutables. Cette tendance est particulièrement remarquable chez les insectes, dont l’immense variété a permis l’émergence d’arsenaux aussi singuliers que spectaculaires.
Le coléoptère bombardier en est un bon exemple ; il est capable de projeter un liquide corrosif en ébullition sur ses prédateurs. Mais certaines espèces d’insectes dits ont développé des stratégies encore plus radicales.
Des insectes kamikazes au service de leur colonie
C’est notamment le cas des insectes « kamikazes ». Comme leur surnom le laisse entendre, ces bêtes peuvent littéralement exploser au visage d’un assaillant, les incapacitant ainsi à l’aide d’une substance visqueuse et toxique !
Pour des raisons évidentes, ce phénomène est exclusivement réservé aux insectes sociaux, où le futur de la colonie prime systématiquement sur la survie des individus. On observe ce comportement chez certains genres de fourmis, comme Colobopsis explodens, et aussi chez des termites.
Mais si le rôle écologique de cette approche est bien compris par les chercheurs, les mécanismes chimiques qui la sous-tendent demeurent assez mystérieux. Une équipe de chercheurs tchèques a donc tenté de comprendre le fonctionnement de ces véritables bombes à retardement vivantes en se basant sur les termites Neocapritermes taracua.
Un détonnateur biologique à la stabilité inexplicable
On sait que leur mécanisme kamikaze est basé sur une enzyme, la laccase BP76, qui s’accumule dans une poche spécialisée sur le dos des ouvrières tout au long de leur vie. Quand la colonie se retrouve menacée, les individus les plus âgés se précipitent vers la menace pour un dernier baroud d’honneur qui consiste à rompre cette espèce de sac à dos.
L’enzyme se mélange alors avec une autre substance relativement inoffensive pour produire une réaction chimique, un peu à la manière des bâtonnets fluorescents à deux compartiments qui sont parfois distribués dans des festivals. La différence, c’est qu’au lieu de produire de la lumière, la réaction crée une substance collante truffée de benzoquinones, des composés chimiques hautement toxiques. Cela a pour effet de tuer l’individu kamikaze, mais aussi d’immobiliser, voire de tuer la cible.

En revanche, ce que les chercheurs ignorent, c’est comment cette enzyme potentiellement explosive peut rester fonctionnelle tout au long de la vie de l’insecte. Les enzymes sont des protéines qui jouent le rôle de catalyseurs biologiques, et ce sont généralement des objets très délicats. La moindre modification du milieu peut endommager ce qu’on appelle le site actif (la région de la protéine qui se fixe à la molécule cible pour catalyser la réaction), l’empêchant ainsi de faire son office.
Maintenir l’intégrité de leur structure en trois dimensions est donc primordial. Mais cela requiert des conditions de pH, de température et d’hydratation bien précises, ce qui force les laboratoires à conserver leurs enzymes dans des substrats liquides à la composition soigneusement contrôlée. Or, personne ne sait comment un être vivant qui évolue dans un environnement très variable (en l’occurrence, la forêt tropicale) est capable de protéger des objets aussi fragiles tout au long de sa vie. C’est d’autant plus perturbant que l’enzyme est conservée sous forme d’un petit cristal bleu solide, ce qui est extrêmement inhabituel ; la majorité des enzymes seraient immédiatement incapacitées dans ces conditions, et ne pourraient donc plus catalyser de réaction une fois remises en solution.
Tout est dans la structure
Pour déterminer l’origine de cette stabilité exceptionnelle, l’équipe de chercheurs tchèques, spécialisée dans la biologie structurale, a analysé toute la structure de la laccase BP76 jusque dans les moindres détails, acide aminé par acide aminé. Pour cela, ils ont utilisé un synchrotron, un accélérateur de particules qui propulse des particules chargées à une vitesse proche de celle de la lumière grâce à un champ magnétique. Dans ces conditions, ces particules émettent un puissant rayonnement électromagnétique à large spectre — le rayonnement synchrotron. Il est utilisé dans des tas de disciplines scientifiques pour obtenir des images très détaillées d’objets minuscules, comme des protéines.
Grâce à cet outil, ils ont pu déterminer que le superpouvoir de l’enzyme résidait entièrement dans sa structure. En effet, l’enzyme est protégée par plusieurs sous-structures qui verrouillent temporairement le site actif. D’autres chaînes de peptides aident la laccase à se replier sur elle-même de façon extrêmement compacte, protégeant ainsi cette zone cruciale. Ces éléments permettent à cette enzyme de rester active même sous forme solide. Une fois qu’elle se mélange avec l’autre liquide, certaines de ces chaînes sont détruites, révélant ainsi le site actif et permettant à la réaction d’avoir lieu très rapidement.
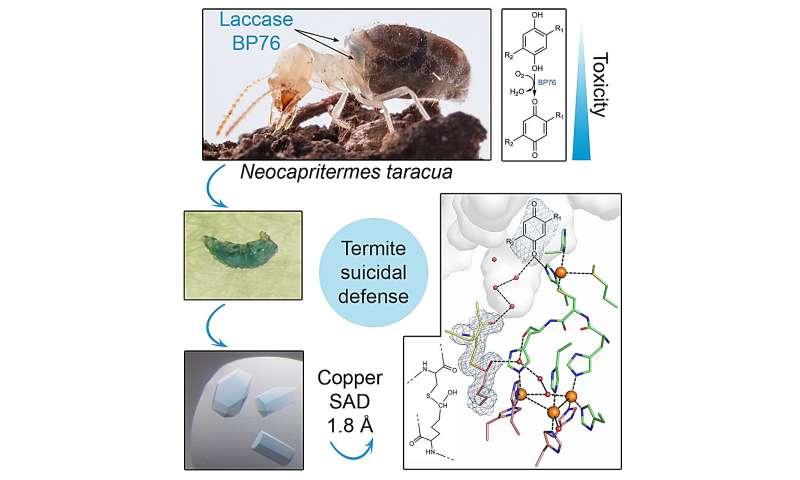
« L’analyse de la structure tridimensionnelle de la laccase BP76 a révélé que cette enzyme utilise diverses stratégies de stabilisation, ce qui la rend non seulement très durable, mais également pleinement fonctionnelle, même dans les conditions difficiles des forêts tropicales humides », explique Jana Škerlová auteure principale de l’étude.
La biologie structurale, clé de compréhension du vivant
Cette conclusion pourrait sembler extrêmement anecdotique — mais il n’en est rien. Les enzymes sont des pièces absolument indispensables du grand puzzle de la vie, et déterminer comment elles sont construites et fonctionnent à la plus petite des échelles est crucial pour comprendre des tas de mécanismes biologiques très importants. À chaque fois que des particularités structurales de ce genre sont identifiées, cela fait émerger de nouvelles clés de compréhension pour les autres chercheurs, qui pourront s’y référer pour d’étudier d’autres mécanismes dans des domaines potentiellement très différents.
« Notre découverte est une excellente illustration du rôle irremplaçable de la biologie structurale. Tout comme la connaissance des composants individuels d’un instrument éclaire son fonctionnement, la connaissance de la structure tridimensionnelle (c’est-à-dire la position des atomes individuels) d’une molécule nous aide à comprendre un processus biologique », souligne Pavlína Řezáčová, directrice du laboratoire d’où proviennent les recherches.
Il sera donc intéressant de voir si les particularités structurales de la laccase BP76 sont retrouvées dans d’autres enzymes, et le cas échéant, quels phénomènes cela permettra d’expliquer.
Le texte de l’étude est disponible ici.
🟣 Pour ne manquer aucune news sur le Journal du Geek, abonnez-vous sur Google Actualités et sur notre WhatsApp. Et si vous nous adorez, on a une newsletter tous les matins.