On dit parfois que l’humain veille sur certaines choses « comme sur la prunelle de ses yeux ». L’expression n’a pas été choisie au hasard ; l’œil est une véritable merveille d’ingénierie naturelle, mais il est aussi excessivement fragile. Lorsque les tissus importants sont endommagés, cela se traduit par une perte de vision souvent irréversible. Mais en attendant une éventuelle révolution apportée par les interfaces cerveau-machine, les progrès de certains chercheurs pourraient tout de même aider les personnes malvoyantes ou atteintes de cécité complète dans un futur relativement proche.
C’est en tout cas ce qu’avancent des chercheurs de l’Université de Wisconsin-Madison, aux États-Unis. Ils travaillent sur la rétine, le tissu le plus important de l’œil. Elle est garnie d’une foule de petites structures baptisées photorécepteurs. Ce sont eux qui permettent de traduire un signal lumineux en signal électrique qui peut ensuite être traité par le cerveau.
Les dégâts de la rétine font partie de ces soucis traditionnellement considérés comme irréversibles. Depuis des années, les chercheurs tentent donc de cultiver des photorécepteurs individuels. L’objectif est de les greffer à une rétine endommagée pour restaurer ses capacités.
Des rétines artificielles cultivées en laboratoire
Ces travaux sont passés à la vitesse supérieure en 2014, quand l’équipe du professeur David Gamm a réussi pour la première fois à générer des ébauches de rétines artificielles. Plus précisément, il s’agissait d’organoïdes, c’est-à-dire des amas de cellules qui fonctionnent un peu comme l’organe modèle. Il existe des tas d’organoïdes différents qui sont utilisés dans le cadre de la recherche, comme ce mini-cerveau artificiel capable de jouer à Pong.
Pour les produire, l’équipe a simplement collecté des cellules souches dites pluripotentes. Ce sont des objets un peu particuliers qui sont avant tout des précurseurs ; au cours du développement, ces cellules répondent à différents signaux biologiques en se transformant (on parle de différenciation). Elles peuvent ainsi former les cellules spécialisées qui constituent les autres tissus, comme la rétine.
Gamm et son équipe ont montré que ces rétines cultivées en laboratoire étaient capables de répondre à différents signaux lumineux en produisant un signal électrique, exactement comme l’œil humain. À partir de là, en théorie, il ne reste plus qu’à transplanter ces cellules synthétiques dans l’objectif de remplacer les tissus endommagés. « Nous voulions utiliser les cellules de ces organoïdes comme des pièces détachées pour remplacer celles qui ont été perdues dans le cadre d’une maladie rétinienne », explique Gamm.
Le défi de la communication cellulaire
Mais son équipe devait encore surmonter un dernier obstacle, et pas des moindres. Car pour fonctionner correctement, tout ce beau monde doit appartenir à une même unité fonctionnelle, comme c’est le cas dans une rétine saine. En d’autres termes, si les cellules ne peuvent pas se parler, elles ne peuvent pas travailler ensemble.
Les chercheurs devaient donc trouver un moyen de forcer ces cellules nerveuses à se rabibocher. Plus précisément, il fallait montrer que leurs synapses (l’interface entre une cellule nerveuse et l’objet avec lequel elle souhaite communiquer) étaient fonctionnelles.
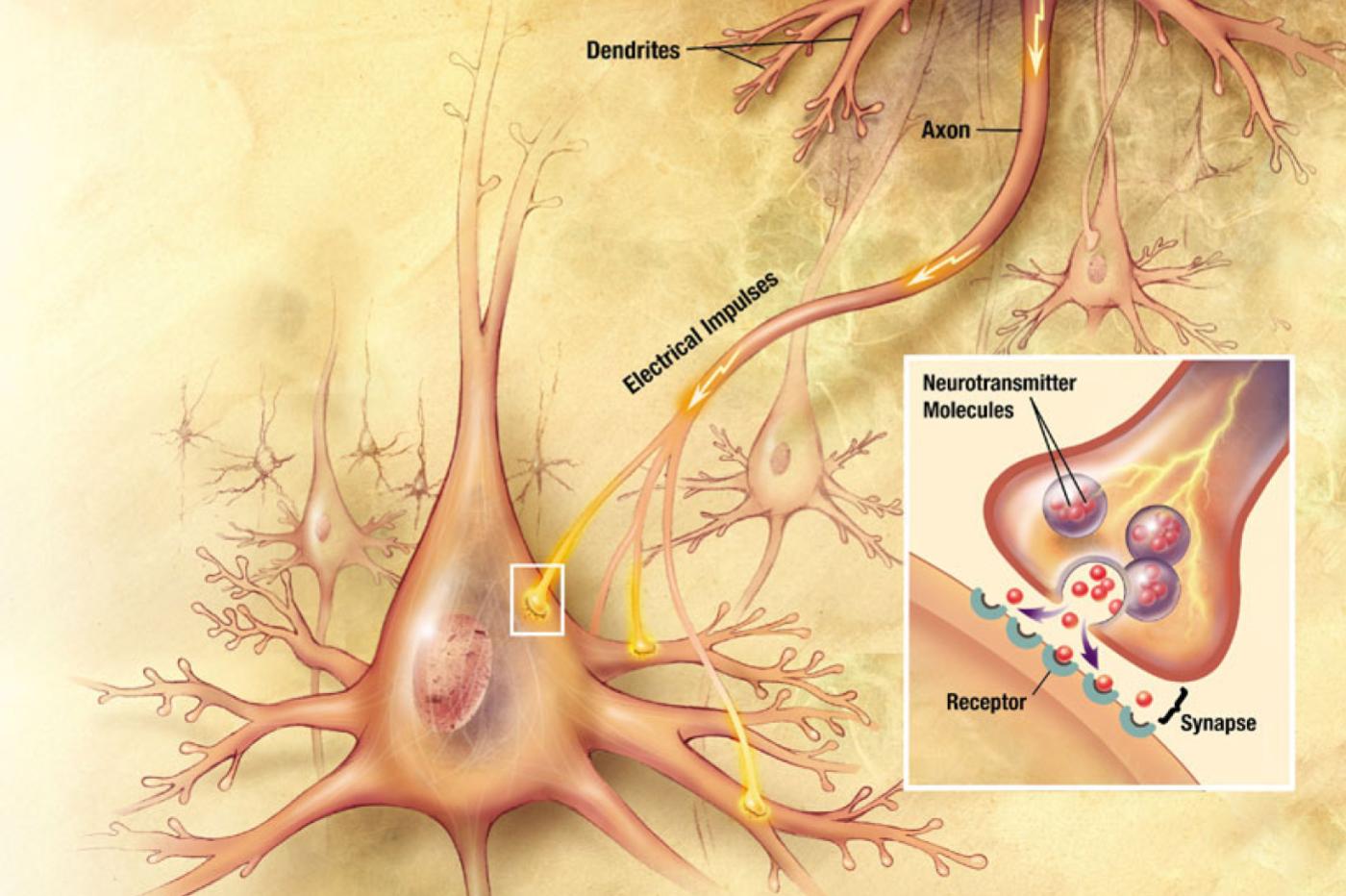
Pour y parvenir, ils ont infecté certaines cellules des organoïdes avec une variante génétiquement modifiée du virus de la rage, qui se déplace à travers les connexions nerveuses. Ils y ont intégré un marqueur fluorescent pour suivre ses allées et venues. Les cellules ont ensuite été séparées pour leur donner l’occasion de se reconnecter.
À la fin de l’expérience, de nombreuses cellules avaient formé des synapses. Et surtout, un grand nombre d’entre elles présentaient ces fameux marqueurs fluorescents.
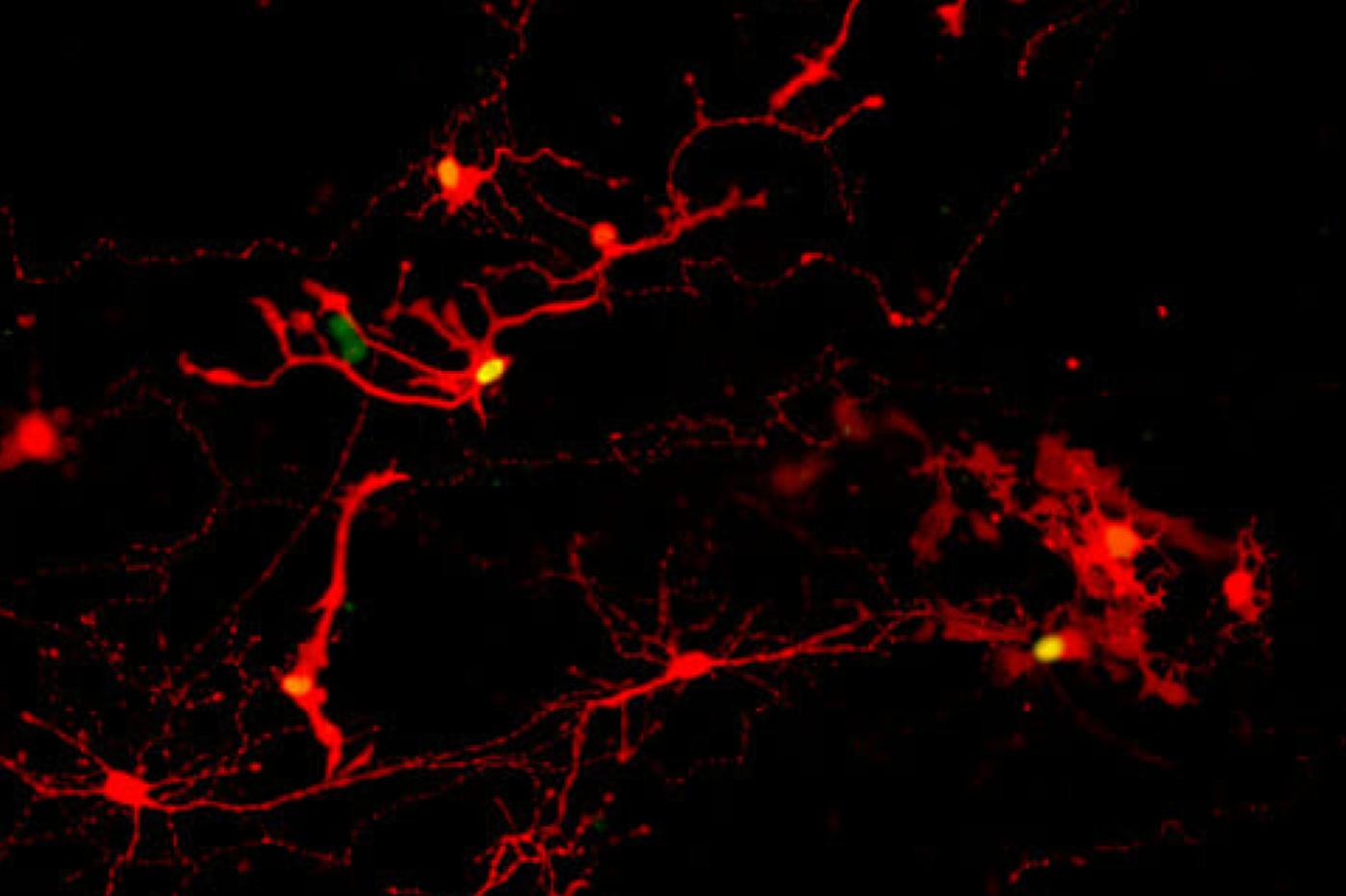
Cela indique que le virus de la rage a bien réussi à traverser la synapse. Par extension, cela signifie que la jonction est fonctionnelle, et que les cellules sont capables de communiquer. En théorie, elles pourraient donc servir à soigner une rétine endommagée.
Dans un communiqué de son université, Gamm affirme que ces travaux représentent la « dernière pièce » de ce grand puzzle; ils ont réussi à prouver définitivement que les synapses des organoïdes étaient bien fonctionnelles.
Vers un essai clinique potentiellement historique
Ils espèrent désormais pouvoir lancer un essai clinique dans un futur relativement proche. L’idée serait de prélever quelques cellules de rétine saine chez un patient, de les mettre en culture, puis de les greffer avec une grande précision. Elles pourraient ainsi se reconnecter entre elles pour participer au fonctionnement de la rétine.
Il faut préciser que jusqu’à preuve du contraire, cette issue relève encore de la théorie. De plus, même si l’essai clinique apporte des résultats concluants, cette technique ne permettra pas de soigner tous les problèmes de vue. Par exemple, elle ne conviendrait pas dans le cas d’un glaucome, qui résulte d’un problème au niveau du nerf optique.
Mais le cas échéant, il s’agirait tout de même d’une vraie révolution pour la médecine appliquée à la vision. D’après les auteurs de l’étude, les problèmes liés aux photorécepteurs restent extrêmement courants. Une telle thérapie pourrait donc représenter une vraie plus-value pour la santé publique.
Il conviendra donc de suivre ces travaux avec une attention toute particulière. Car avec les interfaces cerveau-machine (voir notre article ci-dessous), cette approche basée sur la culture de cellules fait partie des pistes les plus prometteuses pour en finir une bonne fois pour toutes avec ces afflictions extrêmement lourdes à porter au quotidien.
🟣 Pour ne manquer aucune news sur le Journal du Geek, abonnez-vous sur Google Actualités et sur notre WhatsApp. Et si vous nous adorez, on a une newsletter tous les matins.