
CRISPR-Cas9 est plus ou moins devenu la darling de toute la bio-ingénierie ces dernières années. Ce puissant système qui permet d’éditer un génome est utilisé tous les jours dans une pléthore de laboratoires qui travaillent sur un vaste panel de sujets. Pourtant, le couteau suisse préféré de la profession n’est pas parfait et présente tout de même certaines limites. L’une des plus importantes d’entre elles, c’est son impuissance face à l’ADN mitochondrial.
Ces organites (que l’on peut grossièrement assimiler aux minuscules “organes” des cellules) jouent un rôle clé dans notre métabolisme : ils se chargent de recycler l’ATP, que l’on peut assimiler à l’unité d’énergie de base dans notre physiologie. Ils présentent quelques particularités très importantes : ils possèdent leur propre ADN, qui est très différent du reste de notre ADN à bien des égards mais dont les particularités rendent son étude très importante, notamment en médecine. Contrairement à l’ADN dit nucléaire, que l’on trouve dans le noyau des cellules, ce génome dit mitochondrial transmis le plus souvent par la mère comprend bien moins de gènes. Mais comme le génome nucléaire, celui-ci peut muter, et dans certains cas, endommager la capacité de la cellule à s’alimenter en énergie. Cela peut conduire à toutes sortes de conséquences dramatiques, qui vont du diabète à des pathologies gravissimes comme le syndrome de Pearson.
Cela fait donc un certain temps que les scientifiques cherchent à éditer cet ADN mitochondrial, notamment à des fins de thérapie génique. Sauf que comme précisé plus haut, même le fabuleux CRISPR s’est cassé les dents dessus. Cette technique nécessite la présence d’un brin d’ARN pour servir de ligne directrice à l’enzyme Cas9, mais la mitochondrie est un véritable petit château fort dans lequel on ne sait toujours pas introduire ce brin d’ARN : dans ces conditions, pas de CRISPR-Cas9, et pas d’édition génique.
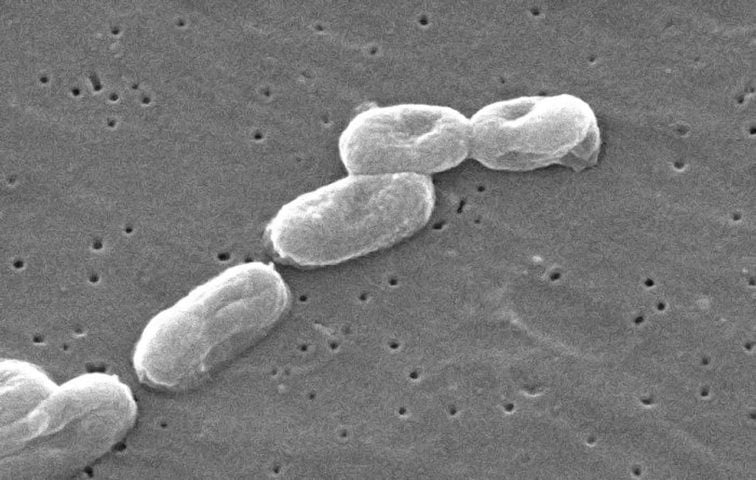
C’était en tout cas le cas jusqu’à cette semaine, quand un micro-organisme nommé Burkholderia cenocepacia est revenu sur la table, à l’occasion d’une étude parue dans Cell. Cette bactérie n’est pas des plus cordiales, puisque dès qu’elle entre en compétition avec ses contemporains pour de la nourriture, elle va leur adresser un véritable croche-patte moléculaire en relarguant une toxine baptisée Ddda.
C’est précisément cette Ddda qui est au cœur de l’innovation d’aujourd’hui. Cette molécule était déjà dans le viseur de la recherche depuis quelques temps pour ses propriétés un peu particulière : pour éliminer la concurrence, elle transforme carrément l’une des briques de base de l’ADN (à savoir la cytosine) en une autre (l’uracile, que l’on ne trouve que dans l’ARN). Cela rend le génome de la cible illisible, ce qui a tout un tas de conséquences physiologiques désastreuses dans un organisme vivant mais en fait un outil potentiellement très intéressant en bio-ingénierie.
Apprivoiser la bête, une nécessité absolue
Sauf que la Ddda, aussi puissante soit-elle, est aussi très difficile à utiliser. Les techniques à base de CRISPR ne peuvent agir que sur un seul brin d’ADN, alors que celui-ci est conditionné sous la forme de la célèbre double hélice dans le noyau des cellules. Cette forme a deux intérêts principaux : gagner (énormément) de place, mais aussi protéger les “briques” qui le constituent. La première étape consiste donc systématiquement à séparer les deux brins à l’aide d’enzymes pour travailler sur un brin seul, un peu comme la tirette d’une fermeture-éclair. Ce qui fait la force mais aussi le risque de la Ddda, c’est qu’elle peut tout à fait opérer sur un double-brin d’ADN !
Il n’y a donc pas besoin de CRISPR, mais cela introduit une difficulté supplémentaire puisqu’il faut “apprivoiser la bête”, pour reprendre les termes du biochimiste David Liu. Parce que là où CRISPR permet des modifications très précises, la Ddda va artiller tous azimuts et ravager toute la séquence d’ADN qu’on lui propose si on la laisse faire – après tout, c’est précisément la raison pour laquelle la bactérie Burkholderia cenocepacia s’en sert pour se débarrasser ses rivales. Inutile de préciser que ce scénario n’est pas franchement idéal dans le cadre d’une thérapie génique… Il manque donc une autre pièce du puzzle, qui permettrait donc d’empêcher ces dégâts collatéraux.
Pour ce faire, les chercheurs ont utilisé une technique très ingénieuse et élégante, baptisée TALEs. Il s’agit d’une classe d’enzymes, que l’on trouve à l’origine plutôt au sein de bactéries des plantes. Elles présentent la particularité de reconnaître, puis de scinder des composés en deux; ils ont ensuite lié ces fragments à des protéines spécialement conçues pour se fixer au niveau de la région cible, directement à l’intérieur de la mitochondrie. Une fois sur place, il suffit de jouer sur ces mêmes protéines pour permettre à la Ddda de se recombiner, et de faire son office à l’endroit précis où on l’attend, sans endommager les régions voisine.
Une technique prometteuse sans aucun concurrent
A l’heure actuelle, avec environ 50% de réussite, cette technique est encore très loin d’être utilisable à des fins thérapeutiques puisque même CRISPR, qui commence pourtant à être très bien maîtrisé, reste encore soumis au principe de précaution. Mais cela représente tout de même une avancée de grande ampleur, dans la mesure où il existe des pistes, mais aucune autre technique concrète capable à ce jour d’arriver une l’édition ciblée comme cette équipe de recherche. L’un des résultats encourageants, c’est que cette technique n’a généré que très peu de mutations dites “off-target”, que l’on peut assimiler à des dommages collatéraux provoqués par une enzyme qui aurait “mal visé”. Cela ouvre la porte à de nombreux traitements dans le cadre de maladies mitochondriales pour lesquelles la médecine avançait bien souvent à tâtons jusqu’à aujourd’hui.
Il faudra encore tester cette technique sur différents types de cellules, mais même avant d’avoir un intérêt thérapeutique, cette technique pourra être utilisée pour “accélérer prodigieusement” le développement d’animaux-modèles sur lesquels les maladies mitochondriales pourraient être étudiées. Un gigantesque pas en avant, et une vraie source d’espoir pour se débarrasser de ces maladies héréditaires.
[amazon box=”2738152619″]
🟣 Pour ne manquer aucune news sur le Journal du Geek, abonnez-vous sur Google Actualités et sur notre WhatsApp. Et si vous nous adorez, on a une newsletter tous les matins.










Génial !
C’est à la fois extraordinaire et tellement flippant… Quand je lis ce genre de news, je ne peux l’empêcher de repenser au livre « Le meilleur des mondes » (de Aldous Huxley)
Bienvenue à Gattaca 🙂
Certains ici devraient plutôt penser à tous ceux qui sont handicapés par une maladie génétique parfois mortel, au lieu de raconter toujours les même absurdités, et nous faire part de leur petite personne effrayée par l’avenir.
L’histoire du mécanisme (troisième paragraphe en partant du bas) est vraiment pas claire… Un schéma aurait été mieux. Dommage, c’était le plus intéressant !!
Cool dans 50 ans tlm aura la mm tronche !