
A partir de cellules récupérées sur la peau d’une personne, une équipe de chercheurs de l’université de Pittsburgh est parvenue à faire pousser des foies humains miniatures qui ont été transplantés à des rats vivants dans un second temps. Ce foie est resté fonctionnel pendant quatre jours, produisant notamment de la bile et de l’urée. Pour y parvenir, l’équipe a d’abord dû trouver le matériel biologique nécessaire à la culture de ces organes. Et pour une telle entreprise, un seul candidat valable existe à notre connaissance : la cellule souche pluripotente, qui présente la particularité de pouvoir se différencier en un tas de types de cellules différentes… à condition d’être exposée au signal chimique adéquat. Pour en obtenir, l’équipe a utilisé une technique qui a révolutionné la médecine en 2006, et a valu un prix Nobel de médecine à son auteur Shinya Yamanaka.
Comment cultive-t-on un organe ?
Ils sont partis de cellules de peau humaine, déjà différenciées, appelées fibroblastes. Comme la grande majorité des cellules, elles sont passées par un processus de différenciation au cours duquel elles ont acquis leurs particularité, et dans l’absolu, il leur serait impossible d’inverser le processus. C’est là que la technique de pluripotence induite de Yamanaka entre en jeu : il s’agit de réintroduire dans la cellule un ensemble de gènes caractéristiques des cellules souche dans une cellule qui s’est déjà spécialisée, à l’aide de techniques de bio-ingénierie. L’objectif : leur rendre leur capacité à se différencier en n’importe quel type de cellule.
Les fibroblastes récupérés sur la peau humaine empruntent donc le chemin inverse de leur développement normal et se dé-différencient : elles reviennent à un stade précoce où elles étaient encore capable de devenir différents types de cellules. On parle alors d’iPSCs, un acronyme anglais qui signifie cellule souche pluripotente induite Il ne reste ensuite qu’à fournir à ces cellules souches les composés qui vont déclencher leur différenciation non pas en cellule de peau, mais cette fois, en une cellule du tissu visé. En l’occurrence, il s’agit de différents tissus du foie comme des hépatocytes ou des cellules biliaires. Une fois le nouvel organe agencé, il ne reste qu’à le transplanter à un rat génétiquement modifié pour inhiber ses réactions immunitaires : indispensable pour éviter une réaction de rejet.
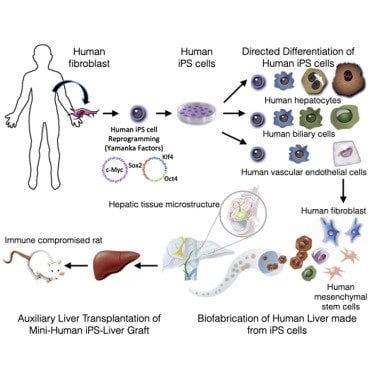
Cette technique, aussi simple et élégante que redoutablement puissante, est depuis devenu un standard absolu dans tous les laboratoires de biologie du développement. Elle permet de créer et d’expérimenter autant que nécessaire sur des amas cellulaires, ce qui évite de nombreux tests in-vivo pas nécessairement plus constructifs et souvent discutables sur le plan éthique.
Un intérêt évident en santé publique
Cette branche de la biologie du développement est particulièrement suivie, car elle pourrait avoir des conséquences très concrètes sur la façon dont nous abordons de nombreuses maladies. Aujourd’hui, le système des greffes d’organe fonctionne sur un système de liste d’attente complètement saturé, faute de donneurs qui ne se bousculent pas au portillon. Pouvoir cultiver des organes personnalisés commencerait par répondre au problème de base de la quantité d’organes disponibles à la greffe.
Et quand bien même un patient parvient à identifier un donneur compatible, la suite du processus ne relève en général pas de la promenade de santé. Une greffe est un processus traumatisant pour l’organisme, qui aura naturellement tendance à considérer le greffon comme un corps étranger. Le résultat peut être une réaction dite de rejet, aux conséquences potentiellement dramatiques. Cela impose de prendre un traitement anti-rejet très lourd… sauf si l’organe est constitué de cellules que l’organisme va identifier comme lui appartenant ! C’est l’un des principaux avantages de cette technique : puisqu’on n’impose pas au système immunitaire de cohabiter avec des cellules qu’il ne reconnaît pas comme les siennes, il n’y aura en théorie aucune réaction de rejet !
L’intérêt de progresser sur le développement, la culture et la greffe d’organes personnalisés à partir de nos propres cellules est donc immense. Une telle technologie permettrait sans le moindre doute de sauver des milliers de personnes, en particulier celles qui n’auraient eu aucune chance de se retrouver en bonne place sur les listes de greffe avec le système actuel. Non seulement trouver un organe sera infiniment plus simple puisqu’il suffira de le cultiver à partir d’une cellule de peau, ou d’une cellule sanguine, mais en plus, les patients ne devront plus prendre de médicaments agressifs toute leur vie. Évidemment, cultiver et greffer un organe humain n’est pas encore d’actualité et va encore demander des efforts conséquents. Mais ce genre d’avancées confirme la viabilité du concept et prouve que la recherche est sur la bonne voie.
🟣 Pour ne manquer aucune news sur le Journal du Geek, abonnez-vous sur Google Actualités et sur notre WhatsApp. Et si vous nous adorez, on a une newsletter tous les matins.











De l’espoir pour ma vieillesse 🙂 Pouvez me rajouter un coeur et 2 poumons aussi svp?